PARP抑制剂国内适应症扩大:HRD卵巢癌患者的福音

近日,阿斯利康与默沙东联合宣布,中国国家药品监督管理局已正式批准其PARP抑制剂利普卓?(奥拉帕利)新适应症,用于同源重组修复缺陷阳性的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗联合贝伐珠单抗治疗达到完全缓解或部分缓解后的维持治疗[1]。
利普卓?在中国获批与贝伐珠单抗联合用于HRD阳性晚期卵巢癌一线维持治疗
此次获批是基于PAOLA-1/ENGOT-ov25 III期关键性试验结果,PAOLA-1/ENGOT-ov25旨在研究接受一线标准治疗(包括贝伐珠单抗)的新诊断晚期卵巢癌患者中奥拉帕利+贝伐珠单抗对比安慰剂+贝伐珠单抗的疗效。PAOLA-1/ENGOT-ov25达到其主要研究终点,在意向治疗(Intent-to-treat, ITT)人群中,与安慰剂+贝伐珠单抗相比,奥拉帕利+贝伐珠单抗治疗组患者进展或死亡风险降低了41%(HR 0.59; 95% CI 0.49-0.72; p<0.0001)。在同源重组缺陷(Homologous recombination deficiency, HRD)阳性患者人群中,与安慰剂+贝伐珠单抗相比,奥拉帕利+贝伐珠单抗中位无进展生存期(Progression-free survival, PFS)延长了近20个月(中位PFS 37.2 vs 17.7个月), 进展或死亡风险下降了67%(HR 0.33; 95% CI 0.25-0.45)。

PAOLA-1研究设计
在2022年ESMO会议上报道了PAOLA-1/ENGOT-ov25最终的总生存期(Overall survival, OS)结果,奥拉帕利+贝伐珠单抗组ITT人群中位OS为56.5个月,安慰剂+贝伐珠单抗组为51.6个月(HR 0.92, 95%CI 0.76–1.12; P=0.4118; OS at 5y, 47.3 vs 41.5%)。在HRD阳性组,使用奥拉帕利+贝伐珠单抗可延长OS (HR 0.62, 95% CI 0.45–0.85; OS at 5 y, 65.5 vs 48.4%)。
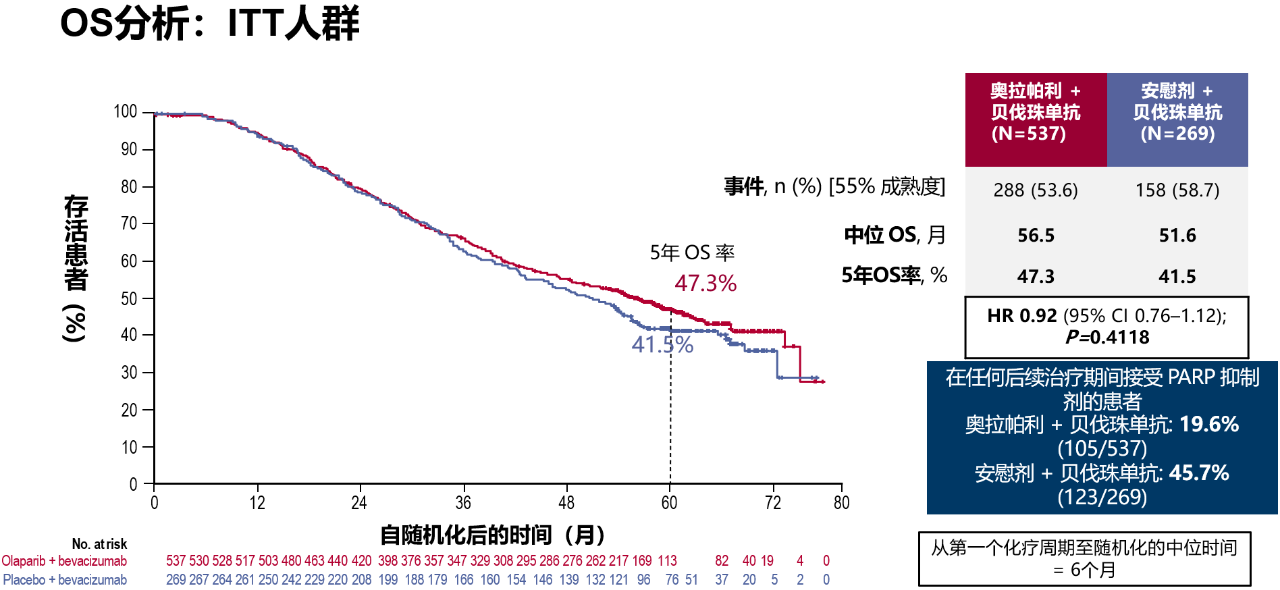
PAOLA-1研究HRD阳性人群最终OS数据
除了PAOLA-1/ENGOT-ov25研究外,2022年ESMO会议上也报道了其他备受关注的,在新诊断卵巢癌中开展的PARP抑制剂临床研究的最新更新数据,下面带大家一一回顾。
一、SOLO1/GOG 3004研究7年随访OS数据更新
SOLO-1/GOG 3004研究评估了奥拉帕利用于新诊断BRCA突变晚期上皮性卵巢癌患者的维持治疗,5年随访时,奥拉帕利组48.3%的患者无进展,安慰剂组20.5%的患者无进展[5]。本次报道了7年随访的OS,是所有PARP抑制剂在新诊断的晚期卵巢癌中最长的随访时间。7年随访数据中:OS的风险比为0.55(95% CI, 0.40-0.76; P=.0004 [需要P<.0001才具有统计学意义]),67.0%的奥拉帕利患者和46.5%的安慰剂患者存活,分别有45.3%和20.6%存活且未接受首次后续治疗(Kaplan-Meier 估计),表明在新诊断的BRCA突变晚期卵巢癌患者中,奥拉帕利维持可改善OS,尽管根据预先指定的标准没有统计学意义,但支持使用奥拉帕利维持治疗可以实现长期缓解。
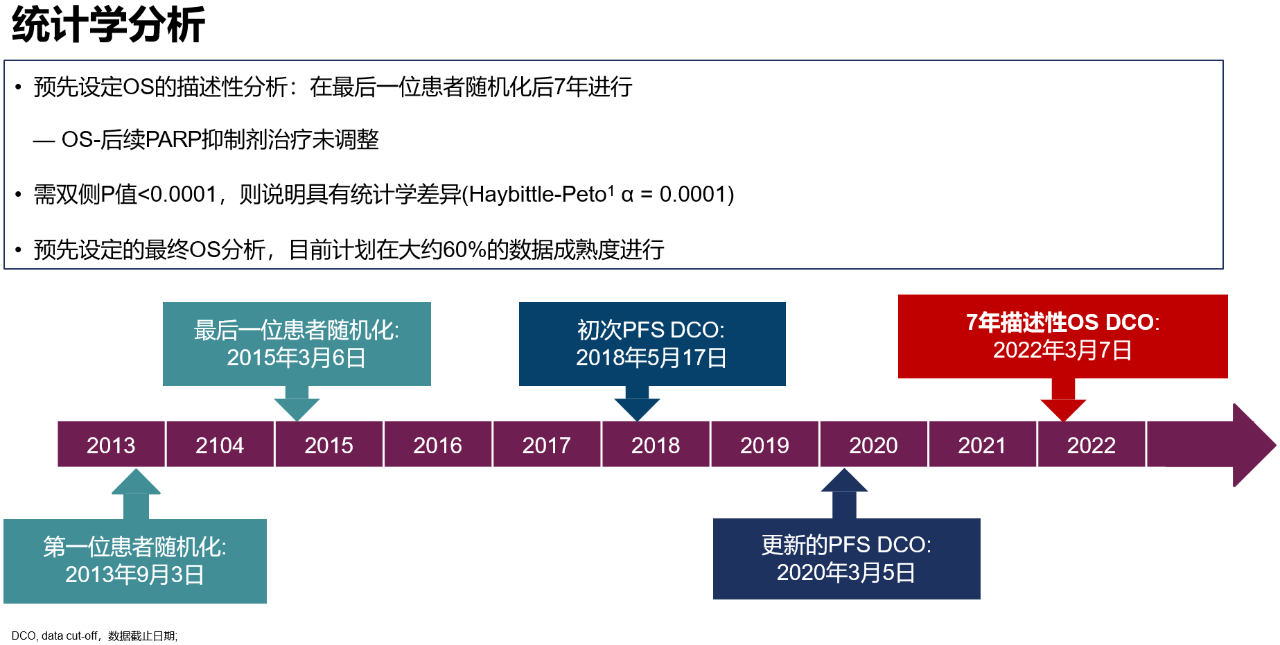
SOLO1研究统计学分析
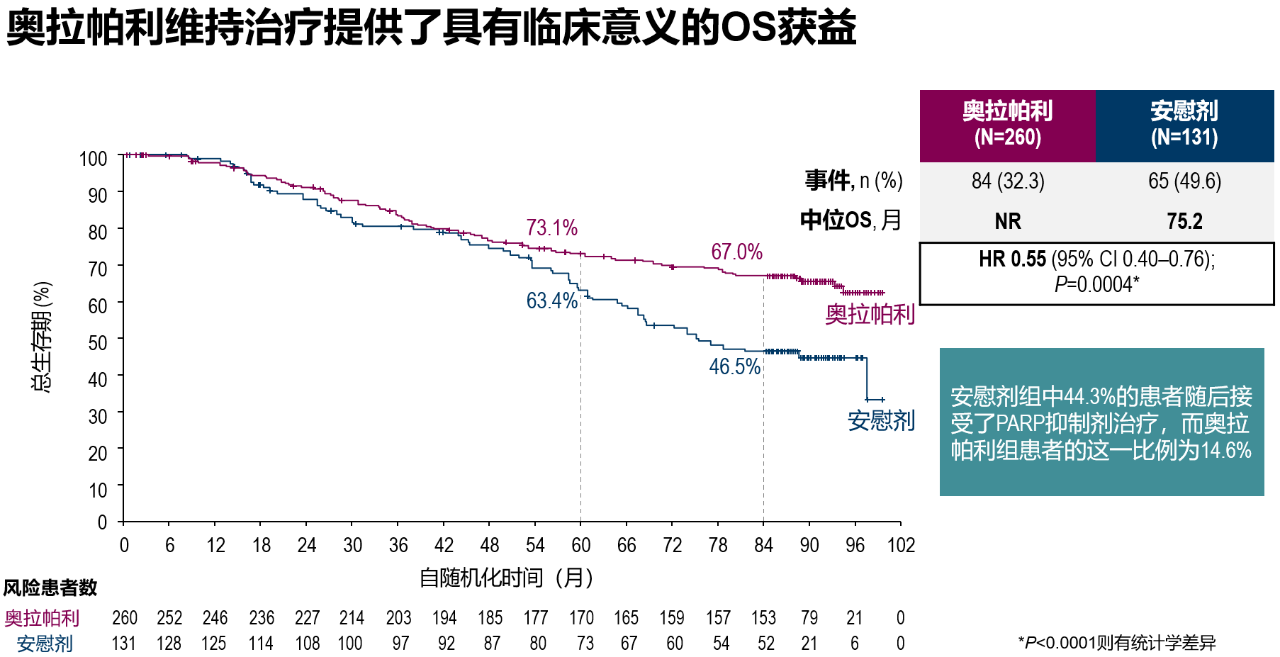
SOLO1研究7年OS数据
二、PRIMA/ENGOT-OV26/GOG-3012研究长期PFS和安全性数据的更新
PRIMA/ENGOT-OV26/GOG-3012研究评估了尼拉帕利在新诊断的晚期卵巢癌患者一线含铂化疗应答后维持治疗的安全性和有效性,在初步分析中,通过盲法独立中心评估(BICR),与安慰剂相比,尼拉帕利维持治疗显著延长了同源重组缺陷(HRd)肿瘤患者(21.9个月vs 10.4个月; HR, 0.43; 95% CI, 0.31-0.59; P<0.001)和总人群(13.8个月vs 8.2个月; HR, 0.62; 95%CI, 0.50-0.76; P<0.001)的PFS[7]。本次报道数据截止至2021年11月17日,中位PFS随访时间为3.5年,总体人群中研究者评估的中位PFS,尼拉帕利vs.安慰剂为13.8 vs 8.2个月(HR 0.66, 95% CI 0.56–0.79, p<0.0001);HRd亚组尼拉帕利vs.安慰剂为24.5 vs 11.2个月(HR 0.52, 95% CI 0.40–0.68, p<0.0001);HRp亚组,尼拉帕利vs.安慰剂为8.4 vs 5.4个月(HR 0.65, 95% CI 0.49–0.87, p= 0.0038)。
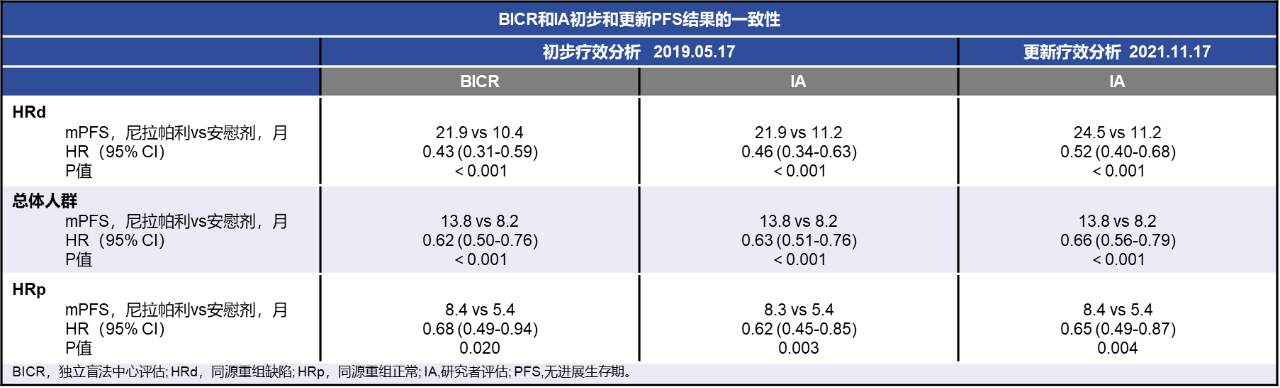
PRIMA研究长期PFS数据
三、ATHENA-MONO研究不同疾病风险亚组获益
ATHENA-MONO研究旨在评估在新诊断FIGO III-IV期高级别卵巢癌中卢卡帕利的疗效,截至2022年3月23日,427名和111名患者分别被随机分配到卢卡帕利或安慰剂组(HRD人群:185 vs. 49)。在HRD(BRCA突变或LOH高BRCA野生型肿瘤)人群中,卢卡帕利组中位无进展生存期(95% CI)为28.7个月(23.0-未达到),安慰剂组为11.3个月(9.1-22.1)(log-rank p=.0004; HR, 0.47; 95% CI, 0.31-0.72);意向治疗人群为20.2个月(15.2-24.7)vs. 9.2个月(8.3-12.2)(log-rank p<.0001; HR, 0.52; 95% CI, 0.40-0.68);HRD阴性人群为12.1个月(11.1-17.7)vs. 9.1个月(4.0-12.2)(HR, 0.65; 95% CI, 0.45-0.95)[9]。
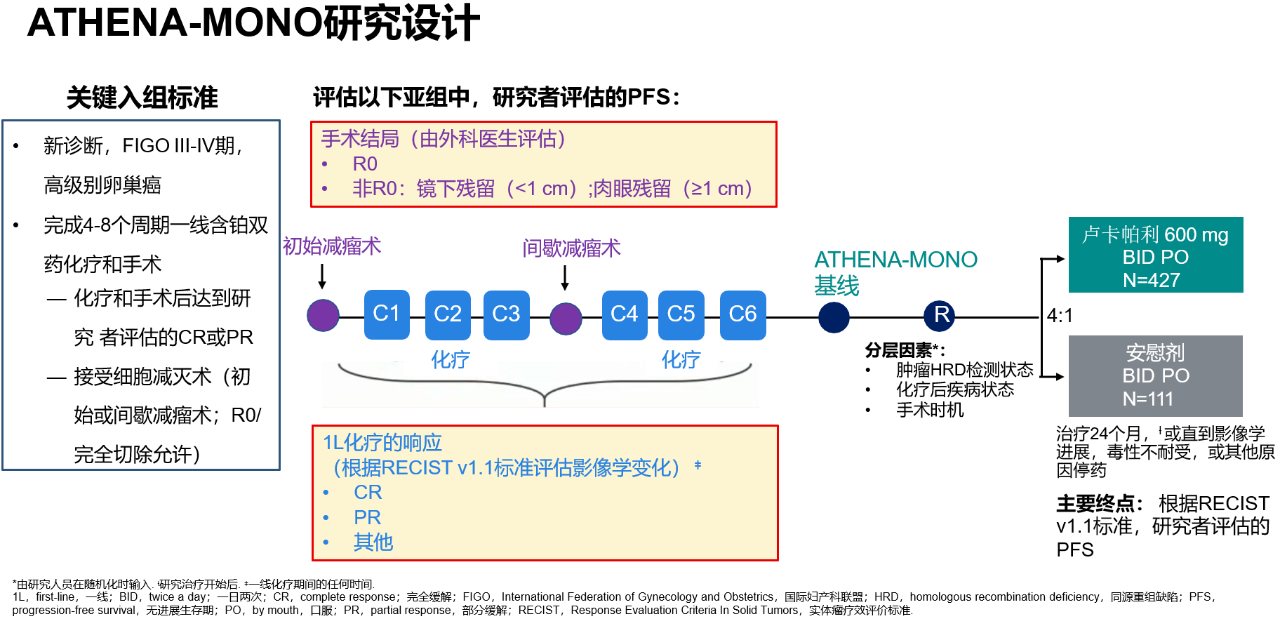
ATHENA-MONO研究设计
四、奥拉帕利作为HRD阳性晚期卵巢癌患者新辅助治疗的初步研究
NCT04417192是一项在HRD阳性III-IV期高级别浆液性或3级子宫内膜样卵巢癌、输卵管癌或原发腹膜癌患者中评价术前奥拉帕利单药(队列1)或联合帕博利珠单抗(队列2)作为新辅助治疗的疗效和安全性。本次报道了队列1的结果,奥拉帕利+帕博利珠单抗新辅助联合治疗的初步研究(队列2)正在进行中。队列1(奥拉帕利单药,n=10),IIIC期3例,IVA期2例,IVB期5例,ORR为50% (95% CI, 18.7-81.3)。
奥拉帕利在国内一线维持治疗适应症的扩大以及2022年ESMO会议报道上各项PARP抑制剂临床试验的结果表明HRD卵巢癌患者可以从PARP抑制剂中明显获益。对于新诊断卵巢癌患者,HRD检测至关重要;而目前国内的HRD检测并不规范,如何选择可靠的HRD检测是医生和患者们需要考虑的问题。普瑞基准的HRD检测产品昂可迪?Pro系列可以检测包含BRCA1/2在内的36基因变异和HRD评分,该模型已经过大规模中国上皮性卵巢癌人群的临床研究(EOC-HRD项目)验证,结果表明在一线辅助化疗(FACT)队列中HRD Status阳性组(GIS Score≥42分或BRCA1/2突变)相比于阴性组患者中位PFS提升5.9个月,中位OS提升29.7个月,一线PARP抑制剂维持治疗(FPMT)队列也可以显著区分获益人群。相关文章即将发表,期待发表后公开更详细的数据,也期待普瑞基准的基因检测产品可以助力于国内更多卵巢癌患者的精准治疗。
相关阅读
-
 科技2022-10-14
科技2022-10-14 -
 医院2022-10-13
医院2022-10-13 -
易文赛自有利用组织再生修复技术(PCC技术)成为骨关节炎患者治疗的新希望
产业2022-10-13 -

-
西比曼二代CAR-T产品1期临床结果发表,客观缓解率达96.4%
临床2022-10-13 -

群贤论道,借力资本市场实现企业高质量发展 ——中国放疗龙头大医的奋斗之路
产业2022-10-13 -

伽玛卫生消毒用品(佛山)有限公司承办“关爱血液病人,为爱加码”公益活动
资讯2022-10-11 -
 产业2022-10-11
产业2022-10-11 -

患者用药绿色通道开启!上尿路尿路上皮癌患者创新药丝裂霉素凝胶在乐城可申请使用
科技2022-10-11 -

求真务实 守正创新 强肝胶囊治疗脂肪肝的真实世界研究全国启动
产业2022-10-10